2022年4月8日,2022全国乳腺癌大会暨中国临床肿瘤学会乳腺癌(CSCO BC)年会召开,期间发布了《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2022版》(CSCO BC 2022),戈沙妥珠单抗(sacituzumab govitecan)被纳入三阴性乳腺癌(TNBC)晚期解救治疗,Ⅱ级推荐。

戈沙妥珠单抗本次能够被纳入CSCO BC 2022指南,是基于此前良好的临床试验结果。Ⅲ期ASCENT研究显示,接受过≥2线标准化疗的转移性三阴性乳腺癌,戈沙妥珠单抗组对比医生选择的化疗方案,中位无疾病进展生存(PFS)分别是5.6个月 vs 1.7个月,中位总生存(OS)分别为12.1个月 vs 6.7个月,客观缓解率(ORR)分别为35%和5%,中位缓解持续时间(DOR)分别为6.3个月和3.6个月。安全性分析显示,其整体安全性良好。基于该研究数据,戈沙妥珠单抗于2021年4月获得美国FDA完全批准,用于既往接受过至少两种系统治疗,其中至少一种为针对转移性疾病的治疗的不可切除的局部晚期或转移性TNBC患者。在中国的注册临床研究中,戈沙妥珠单抗ORR达到38.8%,疗效与安全性与以往研究结果相似。
戈沙妥珠单抗(sacituzumab govitecan)是一款同类首创的抗体药物偶联物,靶点为 Trop-2受体,这是一种在许多类型肿瘤(包括约 90% 的乳腺癌和膀胱癌)中均过度表达的细胞表面抗原。戈沙妥珠单抗专门有一个可与有效载荷拓扑异构酶 I 抑制剂SN-38相连的可水解连接子。这种独特的设计保证了在Trop-2 表达细胞和邻近微环境中的有效活性。
戈沙妥珠单抗以商品名 Trodelvy®已在超过 35个国家/地区获批用于治疗既往接受过至少两种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌(TNBC)成人患者,全球范围内还正在对其进行多项额外的监管审理。Trodelvy还在美国获得加速批准用于治疗先前接受过含铂化疗和程序性死亡受体-1 (PD-1) 或程序性死亡配体 1 (PD-L1) 抑制剂的局部晚期或转移性尿路上皮癌(UC)成人患者。
Trodelvy 还正在开发用于以下人群:其他 TNBC 和转移性 UC,以及 Trop-2 过度表达的一系列肿瘤类型,包括激素受体阳性/人表皮生长因子受体 2 阴性 (HR+/ HER2-) 转移性乳腺癌、转移性非小细胞肺癌 (NSCLC)、转移性小细胞肺癌 (SCLC)、头颈癌和子宫内膜癌。
2020年10月,戈沙妥珠单抗被纳入到更新的2020版《中国晚期乳腺癌规范诊疗指南》,该指南由国家肿瘤质控中心乳腺癌专家委员会、中国抗癌协会乳腺癌专业委员会、中国抗癌协会肿瘤药物临床研究专业委员会共同编撰。2021年10月,被纳入《中国抗癌协会乳腺癌诊治指南与规范(2021)》。2022年4月,被纳入《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2022版》三阴性乳腺癌晚期解救治疗,Ⅱ级推荐。
转移性尿路上皮癌(mUC)一直是临床治疗难点。既往治疗以化疗为主,一线铂类治疗的有效率可达40%以上;无法耐受铂类治疗的患者,往往采用非铂类化疗或PD-1治疗,临床有效率为20%~30%。二线治疗主要采用免疫治疗,若二线治疗失败,临床尝试使用抗体偶联药物(ADC)进行治疗,包括国产药物RC48,国外的EV(Enfortumab vedotin)、戈沙妥珠单抗等多个ADC药物均显示出不错的临床疗效。
目前,ADC药物已经成为mUC治疗的新星,并逐渐从三线治疗向一线治疗集中,特别是临床联合治疗中。在今年的ASCO GU中也有多个联合治疗的研究报道,闪烁出非常绚丽的光彩,如RC48联合Toripalimab、EV联合Pembrolizumab、戈沙妥珠单抗联合Pembrolizumab等研究报道让人眼前一亮。未来,ADC药物联合免疫治疗、化疗,或ADC药物间的联合将为UC治疗提供了新的选择,为提高临床疗效增添可能性。
戈沙妥珠单抗应该说是继EV、RC48后又一非常大的新的亮点。今年ASCO GU公布了TROPHY-U-01研究队列3的数据。
TROPHY-U-01研究是一项国际、多中心、多队列、开放标签的Ⅱ期研究 (NCT03547973)(图1),旨在验证戈沙妥珠单抗在mUC的抗肿瘤活性,其中队列3主要探讨戈沙妥珠单抗联合Pembrolizumab治疗含铂化疗后进展的mUC患者的临床疗效。数据截止时,共入组41例可评价患者,中位随访5.8个月,中位至缓解时间为2.0个月,中位PFS为5.5个月,中位OS未达到[3]。研究入组患者均化疗失败,之后联合治疗的客观缓解率(ORR)达到34%,可以说是较好的。且免疫检查点抑制剂治疗的PFS只有约2个月,所以说这个结果仍是不错,当然临床仍需要更多的实践探索。
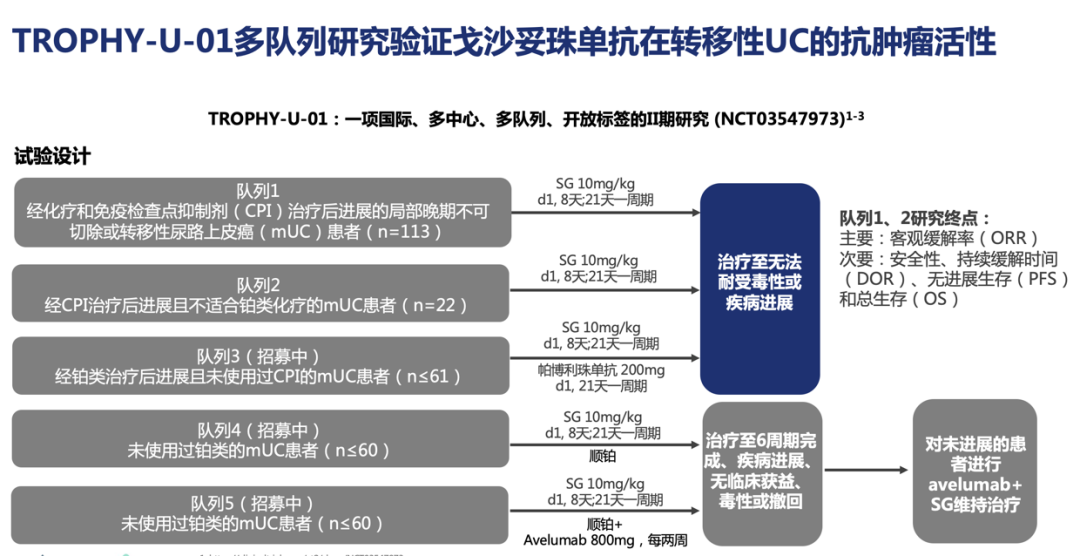
图1. TROPHY-U-01研究设计
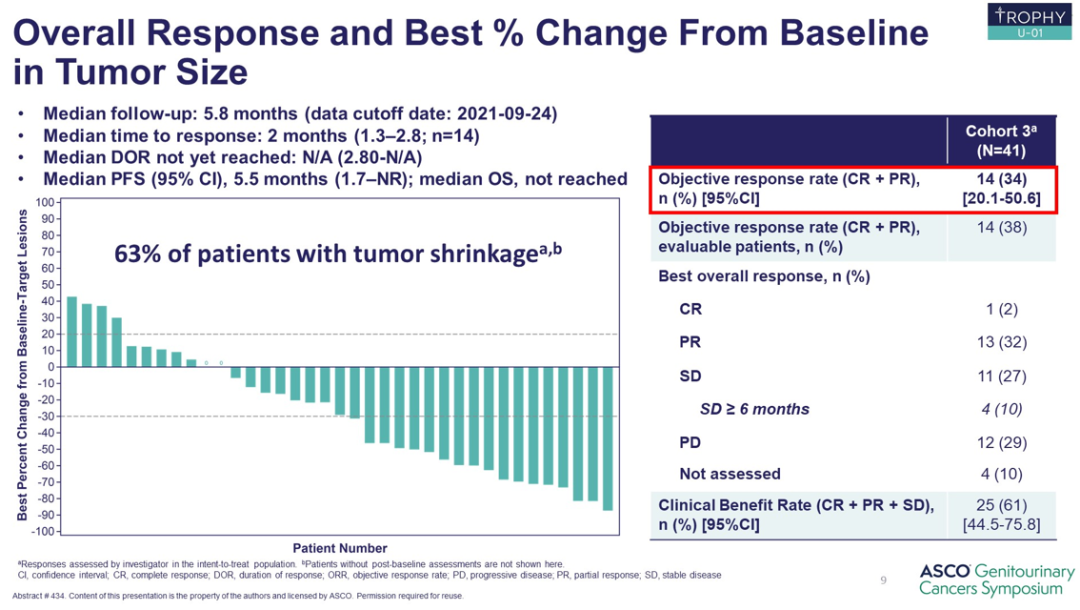
图2. TROPHY-U-01研究队列3结果
而作为Trop-2 ADC类药物的戈沙妥珠单抗具有以下优势:一、戈沙妥珠单抗是靶向Trop-2 ADC,而Trop-2在mUC中的表达率高达95%[4],而在正常组织中表达很低,因此,是mUC患者理想的抗肿瘤治疗靶点,不需要再进行检测以决定是否使用戈沙妥珠单抗;二、戈沙妥珠单抗是由抗Trop-2人源化单克隆抗体hRS7与细胞毒性小分子药物SN-38通过CL2A连接而成。其毒性单元SN-38相较既往的毒性单元MMAE小,比EV、RC48较好,毒副作用相较而言总体可控,相对安全。因为,其联合应用的可能范围更加广阔。相信戈沙妥珠单抗未来在国内能够尽快上市,惠及中国患者,不仅是在三线治疗中,而且通过联合治疗等形式在更早期的一线治疗发挥作用
IMMU-132-01篮子试验
一项旨在评估沙戈沙妥珠单抗治疗晚期上皮癌的疗效和安全性的多中心、单臂、开放标签Ⅰ/Ⅱ期篮子试验。其中,纳入45例既往接受过≥1线治疗的mUC患者,戈沙妥珠单抗治疗的ORR为28.9%,临床获益率(CBR)为44.4%,mPFS和mOS分别为6.8个月和16.8个月,且不良反应与既往一致,临床处理简单、可控[5]。
TROPHY-U-01研究
一项多队列、开放标签的注册性Ⅱ期研究,其中,队列1共纳入113例经含铂化疗或免疫检查点抑制剂治疗后进展的不可切除局部晚期UC或mUC患者,中位随访9.1个月,戈沙妥珠单抗治疗的ORR为27%,mDOR为7.2个月,mPFS为5.4个月,mOS为10.9个月[6],基于该结果,美国FDA加速批准戈沙妥珠单抗用于治疗此前接受过铂类化疗和免疫检查点抑制剂治疗的不可切除局部晚期或转移性尿路上皮癌患者。
注:以上资料来源云顶新耀、肿瘤资讯
