阿斯利康(AstraZeneca)与第一三共制药(Daiichi Sankyo)近日联合宣布,美国食品和药物管理局(FDA)已受理Enhertu(trastuzumab deruxtecan)的补充生物制品许可申请(sBLA):用于治疗先前已接受过一种或多种抗HER2方案的不可切除性或转移性HER2阳性乳腺癌成人患者。FDA已授予该sBLA优先审查,并已指定《处方药用户收费法(PDUFA)》目标日期为2022年第二季度。
Enhertu是一款HER2靶向抗体偶联药物(ADC),由阿斯利康与第一三共合作开发。2021年9月,FDA授予了Enhertu治疗上市适应症的突破性药物资格(BTD)。截至目前,Enhertu已获美国FDA授予4项BTD,其中2项是治疗乳腺癌。
此次sBLA,基于开创性头对头3期DESTINY-Breast03试验的结果:与罗氏HER2靶向ADC产品Kadcyla(trastuzumab emtansine,T-DM1)相比,Enhertu将疾病进展或死亡风险降低了72%。这一前所未有的结果表明:Enhertu有潜力为HER2阳性转移性乳腺癌带来治疗范式转变,并展现了Enhertu在早期治疗环境中改变患者结局的潜力。
乳腺癌仍然是世界上最常见的癌症,2020年诊断出200多万例,导致全球近68.5万人死亡。大约五分之一的乳腺癌病例被认为是HER2阳性。尽管最初使用曲妥珠单抗和紫杉烷进行治疗,HER2阳性转移性乳腺癌患者通常都会经历疾病进展,需要更有效的治疗选择来进一步延迟疾病进展和延长生存期。
Kadcyla是一款已被批准用于治疗上述HER2阳性乳腺癌患者的靶向药物。DESTINY-Breast03是第一个比较Enhertu与阳性对照药物的全球3期头对头试验。先前接受过治疗的HER2阳性转移性乳腺癌患者,采用目前可用的HER2靶向疗法治疗通常会在不到一年的时间内经历疾病进展。在DESTINY-Breast03试验中,接受Enhertu治疗的患者,在各种疗效终点和关键亚组中观察到高度且一致的显著益处,这支持了Enhertu作为这类HER2阳性转移性乳腺癌患者新护理标准的潜力。
DESTINY-Breast03试验的详细阳性结果于2021年9月在欧洲医学肿瘤学会(ESMO)虚拟大会上公布,数据显示:在先前接受过曲妥珠单抗(trastuzumab)和紫杉烷治疗的HER2阳性不可切除性和/或转移性乳腺癌患者中,Enhertu疗效显著优于Kadcyla,在多个疗效终点和关键亚组中观察到高度且一致的显著益处。
会上公布的数据显示,在预先指定的中期分析中,DESTINY-Breast03试验达到了无进展生存期(PFS)主要终点:与Kadcyla相比,Enhertu将疾病进展或死亡风险显著降低72%(HR=0.28;95%CI:0.22-0.37;p=7.8x10E-22)。在分别对Enhertu组和Kadcyla组进行15.5个月和13.9个月的随访后,Enhertu组患者的中位PFS尚未达到(95%CI:18.5-NE),而Kadcyla组患者的中位PFS为6.8个月(95%CI:5.6-8.2)。
在研究者评估的PFS关键次要终点方面,Enhertu组患者的中位PFS是Kadcyla组的3倍(25.1个月 vs 7.2个月;HR=0.26;95%CI:0.20-0.35;p=6.5x10E-24)。在接受Enhertu治疗的关键亚组患者中,包括那些有稳定脑转移史的患者,均观察到一致的PFS益处。
此外,在关键次要终点总生存期(OS)方面:与Kadcyla组相比,Enhertu组显示出OS有改善的强烈趋势(HR=0.56;95%CI:0.36-0.86;名义p=0.007172),但该分析尚不成熟,且无统计学意义。Enhertu组几乎所有患者在一年后均存活(94.1%),Kadcyla组存活率为85.9%。
与Kadcyla组相比,Enhertu组确认的客观缓解率(ORR)提高一倍多(79.7% vs 34.2%)。Enhertu组中观察到42例(16.1%)完全缓解(CR)和166例(63.6%)部分缓解(PR),而Kadcyla组中观察到23例(8.7%)完全缓解(CR)和67例(25.5%)部分缓解(PR)。
该试验中,Enhertu的安全性与先前的临床试验一致,没有发现新的安全性问题。Enhertu组最常见的≥3级治疗期不良事件为中性粒细胞减少(19.1%)、血小板减少(7.0%)、白细胞减少(6.6%)和恶心(6.6%)。根据独立审查委员会确定,有27例(10.5%)治疗相关间质性肺病(ILD)或肺炎报告。大多数(9.7%)为低级别(1级或2级),报告了2例3级(0.8%)事件。未发生4级或5级ILD或肺炎事件。

DESTINY-Breast03试验结果
2019年3月,阿斯利康与第一三共达成了一项总价值69亿美元免疫肿瘤学合作,共同开发Enhertu治疗各种HER2表达水平或HER2突变的癌症患者,包括胃癌、结直肠癌和肺癌、HER2低表达乳腺癌。
Enhertu是一种新一代ADC药物,通过一种4肽链接子将靶向HER2的人源化单克隆抗体trastuzumab(曲妥珠单抗)与一种新型拓扑异构酶1抑制剂exatecan衍生物(DX-8951衍生物,DXd)链接在一起,可靶向递送细胞毒制剂至癌细胞内,与通常的化疗相比,可减少细胞毒制剂的全身暴露。
截至目前,Enhertu(5.4mg/kg)已在多个国家被批准:作为单药疗法,用于治疗在转移性疾病中接受过2种或2种以上抗HER2治疗方案的不可切除性或转移性HER2阳性乳腺癌成人患者。此外,Enhertu(6.4mg/kg)也已在多个国家被批准:用于治疗先前接受了曲妥珠单抗方案的局部晚期或转移性HER2阳性胃或胃食管连接部(GEJ)腺癌成人患者。
乳腺癌是女性中最常见的癌症类型,也是女性癌症相关死亡的首要原因之一。乳腺癌病例中大约20%为HER2阳性,尽管近年来已取得治疗进展并有多款新药获批,但在HER2阳性转移性乳腺癌患者中仍存在着显著的临床需求。这种疾病仍然是无法治愈的,患者在接受目前可用的疗法后最终会病情进展。HER2是一种酪氨酸激酶受体促生长蛋白,表达于多种肿瘤细胞表面,包括胃癌、乳腺癌、肺癌和结直肠癌,与侵袭性疾病和预后较差相关。
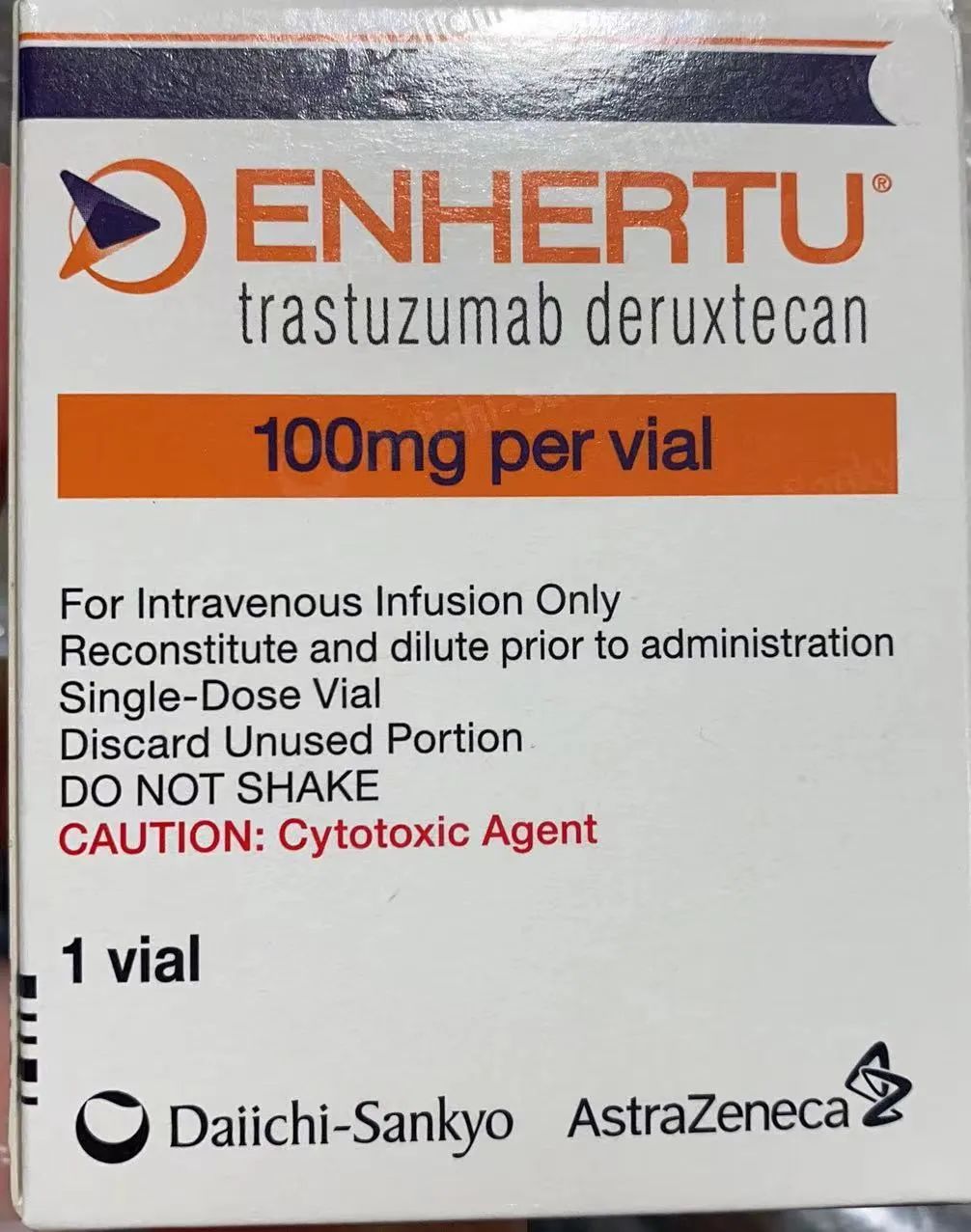
推荐的ENHERTU剂量为5.4 mg / kg,每3周(21天周期)静脉输注一次,直至疾病进展或出现不可接受的毒性。ENHERTU最常见的不良反应有:恶心(79%)、疲劳(59%)、呕吐(47%)、脱发(46%)、表明(35%)、食欲下降(32%)、贫血(31%)、腹泻(29%)、嗜中性白血球减少症(29%)、白血球减少症(22%)、白血球减少症(20%)、咳嗽(20%)、腹痛(19%)、头痛(19%)、上呼吸道感染(15%)
